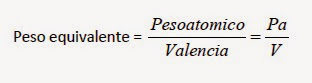1.- Para un elemento simple: Es el peso atómico dividido por la valencia
2.- Cuando se trata de un ácido, el peso molecular se divide por el número de hidrógenos
sustituibles.
3.- Cuando se trata de un hidróxido, el peso molecular se divide por el número de oxhidrilos.
Ejemplo: Para el hidróxido férrico
4.- Cuando se trata de una sal, el peso molecular se divide por el número de cargas positivas o
negativas (del catión o del anión).
martes, 30 de septiembre de 2014
lunes, 29 de septiembre de 2014
EQUIVALENTE GRAMO
De un elemento como la masa del mismo que se combina con 8 gramos
de oxígeno o con 1 gramo de hidrógeno, o con la masa de otro elemento capaz de combinarse a su
vez con 8 gramos de oxígeno o con un 1 gramo de hidrógeno.
domingo, 28 de septiembre de 2014
NÚMERO DE AVOGADRO - II
NÚMERO DE ATOMO GRAMO O NÚMERO DE UN MOL DE ATOMOS (# at-g).- Se halla dividiendo
el peso de un elemento en gramos entre su respectivo peso atómico.
NUMERO DE MOL GRAMO O NUMERO DE MOLES DE MOLÉCULAS (n).- Se halla dividiendo el peso de una sustancia entre su respectivo peso molecular.
NUMERO DE MOL GRAMO O NUMERO DE MOLES DE MOLÉCULAS (n).- Se halla dividiendo el peso de una sustancia entre su respectivo peso molecular.
NÚMERO DE EQUIVALENTE GRAMO (#Eq-g).- Se halla dividiendo el peso de una sustancia entre su respectivo equivalente gramo.
NUMERO DE MOL GRAMO O NUMERO DE MOLES DE MOLÉCULAS (n).- Se halla dividiendo el peso de una sustancia entre su respectivo peso molecular.
NUMERO DE MOL GRAMO O NUMERO DE MOLES DE MOLÉCULAS (n).- Se halla dividiendo el peso de una sustancia entre su respectivo peso molecular.
NÚMERO DE EQUIVALENTE GRAMO (#Eq-g).- Se halla dividiendo el peso de una sustancia entre su respectivo equivalente gramo.
sábado, 27 de septiembre de 2014
NÚMERO DE AVOGADRO - I
Representa el número de átomos que existen en un átomo gramo (mol de átomos) de cualquier
elemento o el número de moléculas que existe en un mol de moléculas de cualquier sustancia,
este número es 6,023 x 1023. Este es el número de átomos o moléculas que se tomo en cuenta
para el peso atómico o peso molecular respectivamente.
En los siguientes cuadros se muestran equivalencias entre pesos atómicos, átomo - gramo, peso
molecular, número de átomos y número de moléculas.viernes, 26 de septiembre de 2014
DEFINICIONES QUÍMICAS
COMPETENCIA: Al término de esta unidad el estudiante debe ser capaz de:
1. Utiliza las definiciones químicas de: peso atómico, número de avogadro y volumen molar.
2. Realiza cálculos de pesos moleculares, números de átomos, número de moles, densidad,
etc.
PESO ATÓMICO O MASA ATÓMICA.- Es la masa relativa de un átomo con respecto a la unidad de
masa atómica (u.m.a.)
Cada elemento químico tiene un peso atómico particular representado por el promedio de masa
de sus isótopos, cuyos valores están especificados en la tabla periódica.
PESO MOLECULAR O MASA MOLECULAR.- Es la masa relativa de una molécula con respecto a la
unidad de masa atómica.
Se halla sumando los pesos atómicos de todos los átomos que forman la molécula.
ÁTOMO GRAMO O MASA DE UN MOL DE ATOMOS (A).- Es igual al peso atómico de un elemento
expresado en gramos.
Ejemplo:
Un at-g de cloro equivale a 35.5 g
Un at-g de hidrógeno equivale a 1,008 g
MOLÉCULA GRAMO O MASA DE UN MOL DE MOLÉCULAS (M).- Es el peso molecular de una
sustancia expresada en gramos.
Ejemplo:
El peso molecular del agua es:jueves, 25 de septiembre de 2014
SALES - II
Como se puede apreciar, las bases son compuestos TERNARIOS con la participación de un METAL
el cual es realmente el que cede el electrón y que le confiere la carga negativa al ANION (OH)-1,
quedando él como un CATION. Esto origina que en interacciones entre compuestos que por su
fórmula sean llamados hidróxidos, alguno de ellos tenga un comportamiento ACIDO, lo cual
depende de la capacidad de ceder electrones de los metales. Aquel que tenga una mayor
electronegatividad se comportara como NO METAL (Al) y el compuesto que lo posea se
comportara como un ACIDO.
A los elementos que dependiendo de las condiciones pueden adquirir características de METAL o
de NO METAL se le conoce como METALOIDE o ANFOTERO. Ejemplos: Zn, Mn, Al, Cr, W, As, Sb,
etc.
Las SALES son sustancias que se componen de un catión y un anión y son de una relativa
estabilidad; su solubilidad y actividad química depende de los elementos que la integran. El
CATION proviene de una BASE y el ANION su origen quizá sea un ACIDO, de los cuales se ha
obtenido por NEUTRALIZACION de las características de ACIDO y BASE. Pueden ser compuestos
BINARIOS, TERNARIOS o CUATERNARIOS.
a) Las sales en solución pueden reaccionar entre sí para dar productos que a su vez son sales pero
de mayor estabilidad:b) En compuestos con CATIONES o ANIONES multivalentes es posible que se den NEUTRALIZACIONES PARCIALES y por lo tanto las sales que así se originen podrán tener características ácidas o básicas.
Este tipo de sales pueden ser neutralizadas con un ión diferente originando SALES MIXTAS.
d) Sales HIDRATADAS.- En ocasiones las sales cristalizan absorbiendo moléculas de agua; a estas se les conoce como SALES HIDRATADAS, su fórmula se escribe anexándole el número de moléculas de agua a la cual se le conoce como AGUA DE CRISTALIZACION.
miércoles, 24 de septiembre de 2014
SALES - I
Los ACIDOS, cuya función química es (H3O)+1 pueden ser compuestos binarios o ternarios.
Formados por la combinación del HIDROGENO con otro elemento o grupos de elementos de gran
electronegatividad cuya principal característica es el aumento de IONES HIDRONIO (H3O)+1 al ser
disueltos en agua. Esto les confiere la propiedad de neutralizar los IONES HIDROXILO (OH)-1
liberados en las soluciones de las BASES formándose AGUA, además de una SAL producto de la
combinación del ION negativo (ANION) y el positivo (CATION) liberados por el ACIDO y la BASE
respectivamente.
Las BASES o HIDROXIDOS, cuya función química es (OH)-1 al ser liberadoras del ANION HIDROXIDO
(OH)-1 serán capaces de neutralizar a los ACIDOS los cuales liberan el CATION de HIDROGENO (H)+1
formando AGUA, por lo que MUTUAMENTE SE NEUTRALIZAN originando sustancias de una relativa
estabilidad.
martes, 23 de septiembre de 2014
LOS ACIDOS HIDRACIDOS
Son ácidos que contienen hidrógeno unido a un no metal solo es posible realizar con la familia de
los halógenos (grupo VII), y los calcógenos (grupo VI) excepto el oxígeno del grupo VI.
NOTACIÓN
Se escriben los símbolos del hidrogeno y del no metal, y se igualan sus números de
oxidación. El hidrogeno trabaja con (+1) y el no metal con número de oxidación negativo.
NOMENCLATURA
Se leen con el nombre genérico ácido el nombre del no metal y su terminación
en hídrico.
Si el número de oxidación del no metal es impar, escribir un hidrógeno H si es par dos hidrógenos
H2 y a continuación se escribe el símbolo del no metal.
lunes, 22 de septiembre de 2014
LOS OXACIDOS CASOS ESPECIALES - II
orto:
Los cinco elementos responden a este caso de la siguiente manera: P, As, Sb, B, Si.
Se escribe los símbolos de Hidrogeno "H", no metal "X" y oxigeno "O": HXO
Si el número de oxidación del no metal es impar, escribir tres hidrogeno H3 si es par cuatro
hidrógenos H4
Sumar el número de oxidación del no metal con los hidrógenos; la mitad del resultado es
el subíndice del oxígeno.
Para nombrar la fórmula se escribe el nombre genérico ácido el nombre del no metal
anteponiendo el prefijo orto ó también se puede nombrar como un acido simple y
dependiendo con el número de oxidación que este trabajando el no metal usaremos las
siguientes terminaciones:
Menor número de oxidación oso (terminación)
Mayor número de oxidación ico (terminación)
domingo, 21 de septiembre de 2014
LOS OXACIDOS CASOS ESPECIALES - I
Los elementos: fósforo «P", Arsénico «As», Antimonio «Sb», Boro «B» Forman ácidos meta, piro, orto, Silicio "Si" Forman ácidos meta y orto.
Meta:
Los cinco elementos responden a este caso de la siguiente manera: P, As, Sb, B, Si.
Se escribe los símbolos de Hidrogeno "H", no metal "X" y oxigeno "O": HXO
Si el número de oxidación del no metal es impar, escribir un hidrógeno H si es par dos hidrógenos H2
Sumar el número de oxidación del no metal con los hidrógenos; la mitad del resultado es el subíndice del oxígeno.
• mayor numero de oxidación ico (terminación)
Meta:
Los cinco elementos responden a este caso de la siguiente manera: P, As, Sb, B, Si.
Se escribe los símbolos de Hidrogeno "H", no metal "X" y oxigeno "O": HXO
Si el número de oxidación del no metal es impar, escribir un hidrógeno H si es par dos hidrógenos H2
Sumar el número de oxidación del no metal con los hidrógenos; la mitad del resultado es el subíndice del oxígeno.
Para nombrar la fórmula se escribe el nombre genérico ácido el nombre del no metal anteponiendo el prefijo meta dependiendo con el número de oxidación que este trabajando el no metal usaremos las siguientes terminaciones:
• Menor numero de oxidación oso (terminación)• mayor numero de oxidación ico (terminación)
Piro:
Los cuatro elementos responden a este caso de la siguiente manera: P, As, Sb, B.
Se escribe los símbolos de Hidrogeno "H" con subíndice 4, no metal "X" con subíndice 2 y
oxigeno su subíndice depende del número de oxidación del no metal": HXO
El número de oxidación del no metal se multiplica por el subíndice del mismo y se suma
cuatro hidrógeno Ha; la mitad del resultado es el subíndice del oxígeno.
Para nombrar la fórmula se escribe el nombre genérico ácido el nombre del no metal
anteponiendo el prefijo piro dependiendo con el numero de oxidación que esté
trabajando el no metal usaremos las siguientes terminaciones:
Menor número de oxidación oso (terminación)
Mayor numero de oxidación ico (terminación)
sábado, 20 de septiembre de 2014
LOS OXACIDOS
Son ácidos que contienen hidrógeno unido a un no metal y oxígeno derivan de los OXIDOS, cuya
función química es (O-2), siendo compuestos BINARIOS se combinan con el agua para producir
compuestos TERNARIOS.
Los OXIDOS ACIDOS reciben este nombre por contener oxígeno en su molécula y porque al
reaccionar con el agua producen sustancias con características ACIDAS, a las que se les llama
OXIACIDOS.
NOTACION.- Se lee con la palabra ácido y el nombre del no metal, utilizando de manera
exactamente igual que para los anhídridos (nomenclatura clásica).
Para nombrar la formula se escribe el nombre genérico ácido el nombre del no metal dependiendo
con el número de oxidación que esté trabajando usaremos las siguientes prefijos y terminaciones:
Regla para escribir fórmula de ácidos
Se escribe los símbolos de Hidrogeno "H", no metal "X" y oxigeno "O": HXO
Si el número de oxidación del no metal es impar, escribir un hidrogeno H si es par dos
hidrógenos H2
Sumar el número de oxidación del no metal con los hidrógenos; la mitad del resultado es
el subíndice del oxígeno.viernes, 19 de septiembre de 2014
OXIDOS NO METALICOS
Son óxidos que contienen un no metal unido a oxigeno. Se escribe los símbolos del no metal y del
oxigeno y se iguala sus números de oxidación. El no metal trabaja con números de oxidación
positivo, y el oxigeno con números de oxidación negativo -2
Obtención:
Nomenclatura sistemática: Óxido del no metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. Para el caso de los óxidos, este tipo de nomenclatura es la mas utilizada, dado que para un no-metal pueden existir varios tipos de óxidos, para los cuales el utilizar los otros tipos de nomenclatura lleva a confusiones. Ejemplos:
Fórmula general:
Nm O con los respectivos coeficientes estequiométricos indicando la cantidad de átomos de cada
elemento.
Nomenclatura tradicional:
Óxido del no metal (si el no metal posee más de un estado de oxidación posible se utilizará oso
para el menor estado de oxidación e ico para el mayor).
Ejemplos:
Nomenclatura de stock:
Óxido del no metal utilizando numeral de stock indicando el estado de oxidación del no metal
cuando este presenta más de un estado de oxidación posible.
Ejemplos:Nomenclatura sistemática: Óxido del no metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. Para el caso de los óxidos, este tipo de nomenclatura es la mas utilizada, dado que para un no-metal pueden existir varios tipos de óxidos, para los cuales el utilizar los otros tipos de nomenclatura lleva a confusiones. Ejemplos:
jueves, 18 de septiembre de 2014
HIDROXIDOS
Son compuestos que contienen un metal unido al grupo hidroxilo, OH, que consta de un átomo de
oxigeno y uno de hidrogeno, y tiene numero de oxidación total -1. Los hidróxidos son compuestos
iónicos: el metal es el ion (+), y el ion hidroxilo OH-,(-).
NOTACION.- Se escriben los símbolos del metal y del grupo hidróxilo, y se igualan sus números de oxidación. El metal trabaja con número de oxidación positivo, y el grupo hidróxilo, con -1.Si son necesarios dos o más grupos hidroxilos, se los encierra entre paréntesis, con el respectivo subíndice fuera. Obtención:
Nomenclatura de stock:
Hidróxido del metal utilizando numeral de stock cuando el metal presenta mas de un estado de
oxidación posible.
Ejemplos:
NOTACION.- Se escriben los símbolos del metal y del grupo hidróxilo, y se igualan sus números de oxidación. El metal trabaja con número de oxidación positivo, y el grupo hidróxilo, con -1.Si son necesarios dos o más grupos hidroxilos, se los encierra entre paréntesis, con el respectivo subíndice fuera. Obtención:
Formula General:
M (OH)n Donde M: metal, y n corresponde al número de iones oxidrilo (OH), que corresponde al
estado de oxidación del metal.
Nomenclatura tradicional:
Hidróxido del metal, utilizando los prefijos oso e ico cuando el metal presenta más de un estado
de oxidación posible.
miércoles, 17 de septiembre de 2014
PEROXIDOS
Son compuestos binarios que contienen un metal unido al ion peroxido, O2
2-, donde el oxigeno
trabaja con el numero de oxidación (-1), el grupo peroxido consta de dos átomos de oxigeno por lo
tanto el numero de oxidación total es (-2)
Para escribir la formula de los peróxidos se anota el símbolo del metal seguido del grupo peróxido
Ejemplo:
Formula General:Nomenclatura sistemática: Óxido del metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. Ejemplos:
lunes, 15 de septiembre de 2014
OXIDOS MIXTOS
Son óxidos que parecen estar formados por la suma de los dos óxidos normales de un mismo
metal, constituyen un caso especial que solo se da con algunos metales, a saber: Fe, Co, Ni, Cr, Mn,
y Pb. Para escribir la formula de los óxidos mixtos más comunes se usa la fórmula general.
Ejemplo:
Nomenclatura sistemática: Óxido del metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. Ejemplos:
Formula General:
M3O4 Donde M metal 3, y O oxigeno 4
Nomenclatura tradicional:
Óxido del metal (si el metal posee más de un estado de oxidación estado de oxidación e ico para el
mayor).
Ejemplos:
Nomenclatura de stock:
Óxido del metal utilizando numeral de stock indicando el estado de oxidación del metal cuando
este presenta más de un estado de oxidación posible.
Ejemplos:Nomenclatura sistemática: Óxido del metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento. Ejemplos:
domingo, 14 de septiembre de 2014
Nomenclatura sistemática
Óxido del metal utilizando prefijos que indiquen la cantidad de átomos de cada elemento.
Para el caso de los óxidos, este tipo de nomenclatura es la más utilizada, dado que para un metal
pueden existir varios tipos de óxidos, para los cuales el utilizar los otros tipos de nomenclatura
lleva a confusiones.
Ejemplos:
sábado, 13 de septiembre de 2014
Nomenclatura de stock
Óxido del metal utilizando numeral de stock indicando el estado de oxidación del metal cuando
este presenta más de un estado de oxidación posible.
Ejemplos:
Ejemplos:
viernes, 12 de septiembre de 2014
Nomenclatura tradicional:
Óxido del metal (si el metal posee más de un estado de oxidación posible se utilizará oso para el
menor estado de oxidación e ico para el mayor).
Ejemplos:
Ejemplos:
jueves, 11 de septiembre de 2014
miércoles, 10 de septiembre de 2014
FAMILIAS DE SUSTANCIAS QUIMICAS
Si bien hemos visto que las sustancias se clasifican en simples y compuestas según contengan
moléculas simples o compuestas. Estas clasificaciones son de gran ayuda en la escritura de las
fórmulas, pero es poca la información que nos brindan sobre las propiedades tanto físicas como
químicas de la sustancia, es por ello que resulta indispensable otra clasificación que los agrupe de
acuerdo a sus propiedades químicas comunes; para tal efecto surgen las siguientes funciones
químicas y grupos funcionales.
OXIDOS
Son compuestos binarios formados por la combinación del oxígeno con otro elemento, si el
elemento es un metal se le conoce como óxido metálico o también como óxido básico casi todos
son compuestos iónicos; el metal es el ion positivo, y el ion oxido O2-, el negativo.
martes, 9 de septiembre de 2014
NOMENCLATURA
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC (unión
internacional de química pura y aplicada). Se aceptan tres tipos de nomenclaturas para los
compuestos inorgánicos; la nomenclatura tradicional, la nomenclatura de stock y la nomenclatura
sistemática.
1.- Las sustancias sencillas o libres se nombran indicando el nombre simple del elemento: Cu
(cobre), Au (oro); H2 (Hidrógeno), etc..
2.- Las sustancias o moléculas compuestas se nombran indicando primeramente el nombre del
anión, seguido del nombre del catión...:
3.- Después del nombre del anión sigue el nombre del catión con las siguientes variantes:lunes, 8 de septiembre de 2014
SUSTANCIAS SIMPLES Y COMPUESTAS - II
Compuestos binarios.- Están formados por átomos de dos elementos diferentes. Se escribe a la
izquierda el menos electronegativo, y a la derecha el más electronegativo:
Compuestos ternarios.- Están formados por tres elementos diferentes. En este tipo de
compuestos suelen formarse grupos de elementos que deben escribirse cerrados en paréntesis
para representar el número de veces que se repita dicho grupo, al igual que en los BINARIOS se
escribe primero el elemento o grupo de elementos menos electronegativo:
Compuestos cuaternarios.- Constituidos por más de tres elementos diferentes.
Suscribirse a:
Entradas (Atom)